DECORVILLS.NET – Tulisan ini akan membahas lengkap tentang tabel periodik unsur kimia, meliputi pengertian, perkembangan, kelebihan dan kekurangan, gambar, klasifikasi, cara membaca, cara menghafal, dan pertanyaan yang sering ditanyakan seputar hal ini.
Pengertian Tabel Periodik
Tahukah Anda apa tabel periodik itu? Tabel periodik adalah tabel yang mengorganisir berbagai jenis unsur kimia berdasarkan nomor atom yang dimiliki unsur masing-masing. Susunan nomor atom ini mencerminkan jumlah proton dalam konfigurasi elektron spesifik, yang menghasilkan karakteristik kimia yang serupa atau mirip di antara unsur-unsur tersebut.
Perkembangan Tabel Periodik Unsur
Tabel periodik yang sekarang dipakai adalah versi moderen. Sebelumnya ada tabel periodik yang disusun oleh seorang ilmuwan. Ilmuwan yang kali pertama yang mengemukakan sistem periodik dalam bentuk tabel adalah Dmitri Mendeleev.
Kelemahan Tabel Periodik yang Dikemukakan Oleh Mendeleev
Dmitri Mendeleev merupakan salah satu ilmuwan yang berjasa dalam penyusunan tabel periodik. Namun, tabel periodik yang disusun oleh Mendeleev juga memiliki beberapa kelemahan. Beberapa kelemahan tabel periodik yang dikemukakan oleh mendeleyev adalah:
- Penyusunan Berdasarkan Berat Atom: Mendeleev mengurutkan unsur berdasarkan berat atom, bukan jumlah proton atau nomor atom. Hal ini menyebabkan beberapa masalah seperti penempatan argon dan potassium yang seharusnya ditukar posisinya jika diurutkan berdasarkan nomor atom.
- Penyisipan Unsur Baru: Mendeleev meninggalkan ruang kosong pada tabel periodiknya untuk unsur-unsur yang belum ditemukan. Meski ini memang bukti kegeniusannya, namun ada beberapa masalah ketika unsur-unsur baru ditemukan dan harus disisipkan ke dalam tabel, khususnya ketika unsur tersebut tidak sepenuhnya sesuai dengan prediksi sifat-sifatnya oleh Mendeleev.
- Posisi Unsur Golongan Nol: Mendeleev tidak memasukkan golongan nol (golongan gas mulia) dalam tabel periodiknya karena unsur-unsur ini belum ditemukan atau diakui pada masanya.
- Pembagian dalam Golongan dan Periode: Tabel Mendeleev tidak dapat menjelaskan alasan mengapa setiap golongan memiliki jumlah anggota yang sama dan mengapa periode dimulai setelah sejumlah unsur tertentu.
- Penyusunan Lantanida dan Aktinida: Mendeleev tidak bisa memprediksi dan menyusun posisi lantanida dan aktinida dengan tepat karena pada masa itu unsur-unsur ini belum ditemukan.
Pada akhirnya, tabel periodik modern berhasil memperbaiki kelemahan-kelemahan dari tabel periodik Mendeleev, dengan mengurutkan unsur berdasarkan nomor atom dan mencakup semua unsur yang telah ditemukan hingga sekarang, termasuk golongan gas mulia, lantanida, dan aktinida.
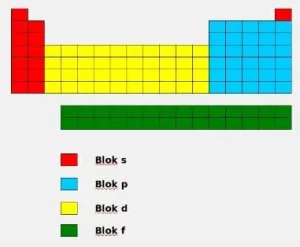
Ada empat bagian dalam tabel periodik, yaitu blok s, p, d, dan f. Dalam satu baris atau periode, bagian sebelah kiri menggambarkan karakteristik logam, sedangkan bagian sebelah kanan memperlihatkan ciri-ciri non logam.
Apa Kelebihan Pengelompokan Unsur Pada Tabel Periodik Mendeleev ?
Meskipun tabel periodik yang dikembangkan oleh Dmitri Mendeleev memiliki beberapa kelemahan, tabel tersebut juga memiliki berbagai kelebihan yang sangat penting, antara lain:
- Prediksi Unsur yang Belum Ditemukan: Salah satu kelebihan paling terkenal dari tabel periodik Mendeleev adalah kemampuannya untuk memprediksi keberadaan dan sifat-sifat unsur yang belum ditemukan pada saat itu. Misalnya, Mendeleev memprediksi keberadaan gallium, scandium, dan germanium sebelum unsur-unsur tersebut ditemukan.
- Pengelompokan Berdasarkan Sifat Kimia: Mendeleev mengelompokkan unsur-unsur berdasarkan sifat kimia mereka, yang memberikan pemahaman yang lebih baik tentang bagaimana unsur-unsur bereaksi dan berinteraksi satu sama lain. Dalam banyak kasus, unsur-unsur yang berada dalam golongan yang sama memiliki sifat kimia yang serupa.
- Konsep Berat Atom: Mendeleev merupakan ilmuwan pertama yang mengakui pentingnya berat atom dalam pengelompokan unsur. Ia menggunakan berat atom sebagai dasar utama untuk menyusun tabel periodiknya, yang menjadi langkah awal penting dalam pengembangan konsep nomor atom.
- Struktur Tabel yang Fleksibel: Meskipun Mendeleev memiliki masalah dengan penempatan beberapa unsur, struktur tabelnya secara umum adalah fleksibel, yang memungkinkan penambahan unsur baru ke dalam tabel tanpa harus mengubah struktur tabel secara signifikan.
- Penekanan pada Pola dan Tren Periodik: Tabel periodik Mendeleev menggarisbawahi pola dan tren periodik dalam sifat-sifat unsur, seperti reaktivitas, titik didih, dan titik leleh. Ini membantu dalam pengembangan teori atom dan memahami perilaku unsur.
Jadi, meskipun tabel periodik Mendeleev memiliki beberapa kekurangan, kontribusinya pada ilmu kimia tidak bisa dipandang sebelah mata. Tabel periodiknya menjadi dasar bagi tabel periodik modern yang kita gunakan saat ini.
Gambar Tabel Periodik
Unsur-unsur yang tersusun dari hidrogen hingga oganesson telah disintesis dan diadaptasi dengan penambahan unsur-unsur kimia terbaru. Nihonium, moscovium, tennessine, dan oganesson adalah tambahan terbaru dalam tabel periodik ini. Penambahan ini telah dikonfirmasi secara resmi oleh International Union of Pure and Applied Chemistry (IUPAC) pada 30 Desember 2015 dan selanjutnya dinamai pada 28 November 2016.
Dari 94 unsur pertama, semuanya muncul secara alami, namun ada beberapa unsur yang harus dibuat di laboratorium karena mereka belum ditemukan dalam lingkungan alami, termasuk beberapa unsur renik dan yang disintesis. Tabel periodik ini dapat digunakan untuk melacak hubungan antara sifat unsur-unsur yang sudah ada dan yang baru ditambahkan. Dengan kata lain, tabel periodik memberikan struktur untuk membantu memahami dan menganalisis perilaku kimia tertentu.
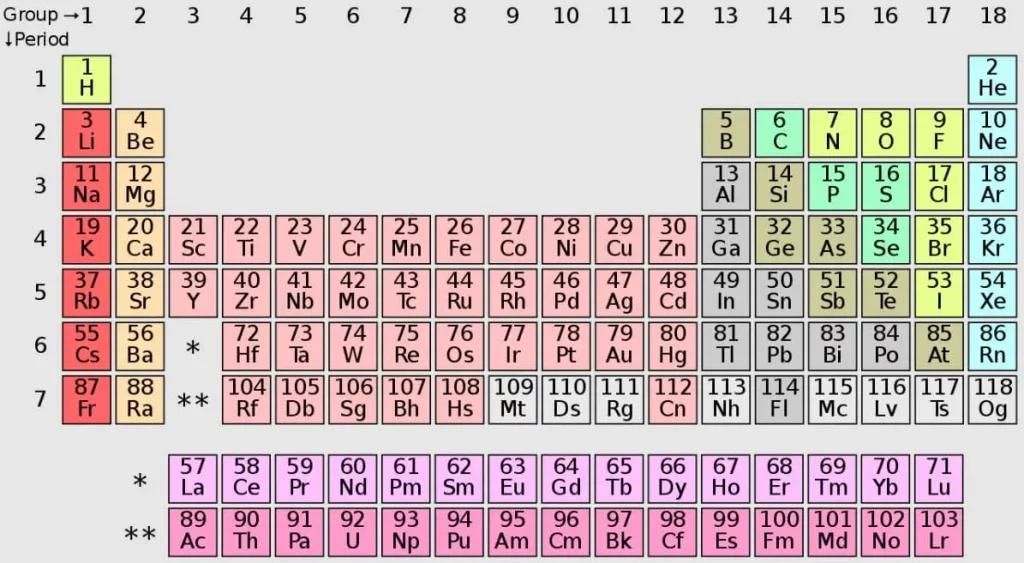
Untuk lebih jelasnya ini urutan nomor atom dari 1-119, nama unsur kimia, dan simbol dari unsur tersebut. Silahkan simak pada tabel di bawah ini.
| Nomor Atom | Nama Unsur Kimia | Simbol |
|---|---|---|
| 1 | Hidrogen | H |
| 2 | Helium | He |
| 3 | Lithium | Li |
| 4 | Berilium | Be |
| 5 | Boron | B |
| 6 | Karbon | C |
| 7 | Nitrogen | N |
| 8 | Oksigen | O |
| 9 | Fluorin | F |
| 10 | Neon | Ne |
| 11 | Natrium | Na |
| 12 | Magnesium | Mg |
| 13 | Aluminium | Al |
| 14 | Silikon | Si |
| 15 | Fosfor | P |
| 16 | Belerang | S |
| 17 | Klorin | Cl |
| 18 | Argon | Ar |
| 19 | Kalium | K |
| 20 | Kalsium | Ca |
| 21 | Scandium | Sc |
| 22 | Titanium | Ti |
| 23 | Vanadium | V |
| 24 | Chromium | Cr |
| 25 | Manganese | Mn |
| 26 | Iron (Ferum) | Fe |
| 27 | Cobalt | Co |
| 28 | Nickel | Ni |
| 29 | Copper (Cuprum) | Cu |
| 30 | Zinc | Zn |
| 31 | Gallium | Ga |
| 32 | Germanium | Ge |
| 33 | Arsenic | As |
| 34 | Selenium | Se |
| 35 | Bromine | Br |
| 36 | Krypton | Kr |
| 37 | Rubidium | Rb |
| 38 | Strontium | Sr |
| 39 | Yttrium | Y |
| 40 | Zirconium | Zr |
| 41 | Niobium | Nb |
| 42 | Molybdenum | Mo |
| 43 | Technetium | Tc |
| 44 | Ruthenium | Ru |
| 45 | Rhodium | Rh |
| 46 | Palladium | Pd |
| 47 | Silver (Argentum) | Ag |
| 48 | Cadmium | Cd |
| 49 | Indium | In |
| 50 | Tin (Stannum) | Sn |
| 51 | Antimony (Stibium) | Sb |
| 52 | Tellurium | Te |
| 53 | Iodine | I |
| 54 | Xenon | Xe |
| 55 | Cesium | Cs |
| 56 | Barium | Ba |
| 57 | Lanthanum | La |
| 58 | Cerium | Ce |
| 59 | Praseodymium | Pr |
| 60 | Neodymium | Nd |
| 61 | Promethium | Pm |
| 62 | Samarium | Sm |
| 63 | Europium | Eu |
| 64 | Gadolinium | Gd |
| 65 | Terbium | Tb |
| 66 | Dysprosium | Dy |
| 67 | Holmium | Ho |
| 68 | Erbium | Er |
| 69 | Thulium | Tm |
| 70 | Ytterbium | Yb |
| 71 | Lutetium | Lu |
| 72 | Hafnium | Hf |
| 73 | Tantalum | Ta |
| 74 | Tungsten (Wolfram) | W |
| 75 | Rhenium | Re |
| 76 | Osmium | Os |
| 77 | Iridium | Ir |
| 78 | Platinum | Pt |
| 79 | Gold (Aurum) | Au |
| 80 | Mercury (Hydrargyrum) | Hg |
| 81 | Thallium | Tl |
| 82 | Lead (Plumbum) | Pb |
| 83 | Bismuth | Bi |
| 84 | Polonium | Po |
| 85 | Astatine | At |
| 86 | Radon | Rn |
| 87 | Francium | Fr |
| 88 | Radium | Ra |
| 89 | Actinium | Ac |
| 90 | Thorium | Th |
| 91 | Protactinium | Pa |
| 92 | Uranium | U |
| 93 | Neptunium | Np |
| 94 | Plutonium | Pu |
| 95 | Americium | Am |
| 96 | Curium | Cm |
| 97 | Berkelium | Bk |
| 98 | Californium | Cf |
| 99 | Einsteinium | Es |
| 100 | Fermium | Fm |
| 101 | Mendelevium | Md |
| 102 | Nobelium | No |
| 103 | Lawrencium | Lr |
| 104 | Rutherfordium | Rf |
| 105 | Dubnium | Db |
| 106 | Seaborgium | Sg |
| 107 | Bohrium | Bh |
| 108 | Hassium | Hs |
| 109 | Meitnerium | Mt |
| 110 | Darmstadtium | Ds |
| 111 | Roentgenium | Rg |
| 112 | Copernicium | Cn |
| 113 | Nihonium | Nh |
| 114 | Flerovium | Fl |
| 115 | Moscovium | Mc |
| 116 | Livermorium | Lv |
| 117 | Tennessine | Ts |
| 118 | Oganesson | Og |
Istilah Pada Tabel Periodik
Apa saja istilah yang digunakan pada tabel periodik ini? Yuk kita simak satu persatu.
1. Periode
Periode merujuk pada baris mendatar dalam struktur tabel periodik kimia, dengan tren mendatar yang biasanya lebih jelas dibandingkan tren vertikal, yang kadang-kadang lebih sulit untuk dipahami.
Dapat dilihat di Bagian blok-f tabel periodik, yang mencakup lantanida dan aktinida, membentuk dua rangkaian unsur mendatar. Rangkaian ini berperan penting dalam menetapkan karakteristik unsur kimia.
2. Golongan
Istilah ‘golongan’ dalam konteks tabel periodik kimia seringkali disebut juga sebagai ‘famili’. Ini mengacu pada bagian tabel periodik yang terbentuk dalam bentuk kolom vertikal dan mengikuti suatu tren periodik, bukan berdasarkan periode atau blok tertentu.
3. Blok-s
Unsur-unsur dalam blok-s dapat ditemukan di bagian kiri dari tabel periodik konvensional. Blok ini mencakup dua kolom pertama (sebelah kiri) dan juga satu kolom terakhir (paling kanan), yang mencakup unsur-unsur seperti hidrogen dan helium yang merupakan nonlogam, serta logam alkali dan logam alkali tanah yang masing-masing terdapat pada golongan 1 dan 2.
Unsur-unsur dalam blok S dikarakteristikkan oleh keberadaan elektron valensi pada orbital luar mereka. Nilai status oksidasinya adalah nol, plus satu, atau plus dua. Mereka memiliki kemampuan untuk membentuk ikatan logam dan ikatan ionik. Faktanya, setiap elemen dalam blok ini adalah logam. Dalam perbandingan, keelektronegatifan mereka cenderung lebih rendah.
4. Blok-p
Blok-p dalam struktur tabel periodik kimia mencakup enam golongan, dari golongan 13 hingga 18, sejalan dengan aturan IUPAC, atau dari 3A hingga 8A sesuai dengan terminologi Amerika. Selain itu, sebagian besar unsur yang termasuk dalam blok-p adalah metaloid.
5. Blok-d
Dalam struktur tabel periodik kimia, blok-d mencakup golongan 3 hingga 12, atau dari golongan 3B hingga 2B menurut terminologi Amerika. Semua unsur yang terdapat dalam blok-d ini merupakan logam transisi.
6. Blok-f
Blok-f dalam struktur tabel periodik kimia biasanya ditempatkan di bagian bawah. Penting untuk diingat bahwa blok-f ini tidak memiliki nomor golongan spesifik dan mencakup unsur-unsur lantanida dan aktinida.
Klasifikasi Tabel Periodik
Unsur-unsur kimia dikelompokkan berdasarkan karakteristik fisika dan kimia mereka, sesuai dengan sifat-sifat yang mereka tunjukkan. Oleh karena itu, ada beberapa klasifikasi yang perlu And pahami untuk dapat memahami tabel periodik dengan tepat. Contohnya adalah sebagai berikut:
1. Sifat-Sifat Umum
Pada dasarnya, unsur-unsur kimia dapat dikelompokkan ke dalam tiga kategori berdasarkan sifat fisika dan kimia mereka: logam, metaloid, dan nonlogam. Berikut adalah penjelasan mendetail mengenai sifat-sifat umum dari unsur-unsur kimia:
a. Logam
Logam umumnya merupakan bahan padat yang memiliki kilauan dan konduktivitas yang tinggi. Mereka juga bisa membentuk paduan dengan logam lain dan membentuk senyawa ion seperti garam dengan non-logam (kecuali gas mulia). Berikut adalah ciri-ciri logam dalam tabel periodik:
- 78% dari semua unsur yang sudah dikenali termasuk dalam kategori logam
- Umumnya ditemukan di bagian kiri tabel periodik
- Kebanyakan berwujud padat pada suhu ruangan
- Biasanya memiliki titik leleh dan titik didih yang relatif tinggi
- Merupakan konduktor yang baik untuk panas dan listrik
- Dapat diproses melalui penempaan dan peregangan
b. Non logam
Pada umumnya unsur Non-logam memiliki wujud gas. Unsur bisa berwarna atau tidak berwarna. Ini juga bisa membentuk senyawa kovalen dengan nonlogam lain. Berikut ini adalah ciri-ciri nonlogam dalam tabel periodik:
- Posisinya ada di bagian kanan atas tabel periodik
- Terdapat total 22 unsur non-logam
- Kebanyakan berbentuk padat atau gas pada suhu ruangan
- Memiliki titik leleh dan titik didih yang relatif rendah
- Konduktivitas panas dan listriknya kurang baik
c. Metaloid
Metaloid biasanya menunjukkan sifat-sifat yang berada di antara logam dan non-logam atau merupakan campuran dari kedua jenis unsur tersebut.
| Logam | Non-Logam | Metaloid | |
|---|---|---|---|
| Persentase dalam semua unsur | 78% | N/A | N/A |
| Posisi dalam tabel periodik | Kiri | Kanan atas | Bervariasi |
| Jumlah dalam tabel periodik | N/A | 22 | N/A |
| Wujud pada suhu ruangan | Kebanyakan padat | Kebanyakan padat atau gas | Bervariasi |
| Titik leleh dan didih | Tinggi | Rendah | Bervariasi |
| Konduktivitas panas dan listrik | Baik | Kurang baik | Bervariasi |
| Dapat diproses | Ya, melalui penempaan dan peregangan | Tidak, umumnya | Bervariasi |
| Membentuk senyawa | Ya, seperti garam dengan non-logam | Ya, senyawa kovalen dengan non-logam lain | Bervariasi |
Dalam tabel periodik, klasifikasi biasanya ditandai dengan perbedaan warna pada tabel. Pembatasan antara unsur logam dan non-logam ditentukan oleh jumlah relatif masing-masing dalam tabel periodik. Logam dan nonlogam kemudian dikelompokkan ke dalam subkategori, dengan gradasi sifat dari logam ke nonlogam untuk unsur dalam periode yang sama.
Logam mencakup alkali yang sangat reaktif, logam alkali tanah yang kurang reaktif, lantanida dan aktinida, logam transisi, dan logam pasca-transisi. Sementara itu, nonlogam terdiri dari unsur poliatomik, nonlogam esensial yang memiliki sifat mirip dengan metaloid, dan gas mulia monoatomik yang hampir sepenuhnya inert. Metaloid, seperti silicon, germanium, arsen, dan antimon, menunjukkan sifat logam dan nonlogam.
2. Keadaan Materi
Faktor lain yang mempengaruhi klasifikasi unsur-unsur kimia adalah keadaan atau fase materi tersebut, seperti apakah itu padat, cair, atau gas dalam suhu dan tekanan standar (STP).
Umumnya, unsur dalam bentuk padat ada pada suhu dan tekanan atmosfer normal, sementara beberapa berada dalam fase gas. Hanya brom dan raksa yang berada dalam keadaan cair pada suhu 0 °C atau sekitar 32 °F dengan tekanan atmosfer normal.
3. Massa Jenis
Klasifikasi dalam tabel periodik juga seringkali mengacu pada massa jenis pada suhu dan tekanan standar (STP) sebagai karakteristik dari unsur kimia. Massa jenis biasanya dinyatakan dalam gram per sentimeter kubik atau g/cm3.
Massa jenis juga kerap digunakan untuk mendeskripsikan unsur dalam bentuk gas pada suhu tertentu. Misalnya, ketika gas dicairkan atau dibekukan, unsur tersebut akan memiliki massa jenis yang sama dengan unsur kimia lainnya.
Ketika sebuah unsur memiliki banyak alotrop dengan massa jenis yang berbeda, biasanya salah satu alotrop dipilih sebagai perwakilan untuk disajikan dalam ringkasan. Sementara massa jenis masing-masing alotrop dapat dijelaskan lebih detail. Misalnya, karbon memiliki tiga alotrop: karbon amorf, grafit, dan intan, dengan massa jenis masing-masing 1,8-2,1; 2,267; dan 3,515 g/cm3.
4. Titik Lebur Dan Titik Didih
Titik leleh dan titik didih digunakan untuk menggambarkan karakteristik unsur, yang biasanya dinyatakan dalam derajat Celsius pada tekanan atmosfer tertentu.
Walaupun klasifikasi unsur berdasarkan titik leleh dan titik didih umumnya sudah dikenal, masih ada beberapa unsur radioaktif dengan kuantitas yang sangat kecil yang belum diketahui. Helium, atau He, memiliki titik didih tetapi tidak memiliki titik leleh dalam presentasi konvensional, karena tetap dalam fase cair bahkan pada suhu nol absolut dalam tekanan atmosfer.
5. Struktur Kristal
Harap diketahui bahwa unsur-unsur yang telah diteliti sebagai contoh zat padat menunjukkan delapan jenis struktur kristal dalam komposisinya. Ini mencakup struktur kubik, kubik berpusat di badan, kubik berpusat di muka, heksagonal, monoklinik, ortorombik, rhombohedral, dan tetragonal. Untuk beberapa unsur sintetis transuranium, sampel yang tersedia terbatas dan tidak cukup untuk menentukan struktur kristalnya.
6. Asal Usul di Bumi
Ada 94 unsur yang terbentuk secara alami, sementara 24 unsur lainnya dibuat secara artifisial sebagai hasil dari sintesis melalui reaksi nuklir buatan.
Sebanyak 83 unsur dianggap sebagai unsur primordial dan stabil atau hanya sedikit radioaktif. Sebelas unsur lainnya dianggap sebagai unsur efemeral karena memiliki waktu paruh yang singkat sejak awal pembentukan tata surya. Lima dari 11 unsur efemeral tersebut adalah polonium, radon, radium, actinium, dan protactinium.
Unsur-unsur tersebut merupakan hasil peluruhan dari torium dan enam unsur lainnya adalah unsur-unsur efemeral yang dihasilkan melalui reaksi nuklir yang jarang terjadi, yang melibatkan titanium atau elemen-elemen berat lainnya. Unsur yang tersisa mencakup teknesium, astatin, prometium, neptunium, fransium, dan plutonium.
Cara Membaca Tabel Periodik
Nah, kita tadi sudah belajar memahami arti dan detail tabel periodik kimia. Saatnya kita mengetahui bagaimana cara membaca tabel periodik agar dapat menentukan unsur kimia dengan akurat. Berikut adalah beberapa tips untuk membaca tabel periodik dengan memahami beberapa konsep berikut:
1. Menginterpretasikan Tabel Periodik Dari Atas Kiri Ke Bawah Kanan
Tabel unsur kimia ini disusun berdasarkan nomor atom, jadi semakin ke kanan dan ke bawah, nomor atom akan semakin besar. Nomor atom pada tabel periodik adalah jumlah proton dalam atom unsur dan semakin ke kanan, massa atom akan semakin besar. Anda dapat memahami berat suatu unsur hanya dengan melihat posisinya pada tabel periodik.
Ketika bergerak ke kanan dan ke bawah pada tabel periodik, massa atom unsur kimia bertambah karena dihitung berdasarkan jumlah proton dan neutron di setiap atom. Massa atom ini akan terus bertambah seiring dengan peningkatan jumlah proton, sementara jumlah elektron memiliki sedikit pengaruh terhadap berat atom.
2. Memahami Unsur Kimia
Setiap unsur kimia selalu memiliki satu proton lebih dari atom di sebelah kiri di tabel periodik. Untuk mengatasi ini, Anda dapat melihat nomor atom yang tersusun dari kiri ke kanan.
Unsur-unsur ini dibagi menjadi tiga kelompok, misalnya baris pertama menunjukkan hidrogen dengan nomor atom 1, dan helium dengan nomor atom 2. Anda dapat menentukan bahwa kedua unsur ini berada di ujung kiri dan kanan tabel periodik karena mereka berada dalam kelompok yang berbeda.
3. Kenali Golongan Atom Dengan Sifat Fisik Yang Sama
Golongan dalam tabel periodik ditunjukkan oleh kolom vertikal dan ditandai dengan warna yang sama. Warna ini dapat membantu Anda mengidentifikasi unsur-unsur yang memiliki sifat fisik dan kimia yang serupa. Hal ini akan memudahkan untuk memprediksi reaksi unsur kimia dalam setiap grup meskipun jumlah elektron mereka sama.
Setiap unsur hanya termasuk dalam satu grup, kecuali hidrogen yang termasuk dalam grup halogen atau logam alkali. Bahkan hidrogen muncul di kedua grup dalam tabel periodik.
4. Perhatikan Ruang Kosong Dalam Tabel
Hal lain yang perlu Anda perhatikan adalah pengaturan unsur-unsur ke dalam kelompok dan grup untuk memperkirakan sifat fisik dan kimia yang sama. Cara ini memudahkan Anda memahami bagaimana setiap unsur bereaksi.
Seiring bertambahnya jumlah unsur, pengelompokannya semakin sulit, itulah sebabnya ada ruang kosong dalam tabel unsur kimia. Misalnya, tiga baris pertama tabel memiliki ruang kosong yang disediakan untuk logam transisi yang akan muncul di tabel periodik, yaitu nomor atom 21.
5. Perhatikan Bahwa Setiap Baris Disebut Periode
Semua unsur dalam satu periode memiliki jumlah orbital atom yang sama, yang akan diisi oleh elektron tertentu. Jumlah orbital ini akan sesuai dengan jumlah periode pada tabel periodik yang menunjukkan 7 baris yang berarti 7 periode.
Misalnya, unsur pada periode 1 memiliki 1 orbital, sedangkan unsur pada periode 7 memiliki 7 orbital. Nomor-nomor ini diberikan dari 1 hingga 7 dari atas ke bawah di bagian kiri tabel periodik.
6. Membedakan antara Logam, Metaloid, dan Non-logam
Anda perlu mengenali tipe unsur untuk memahami lebih mudah sifat-sifat unsur di dalam tabel periodik. Klasifikasi ini ditandai dengan perbedaan warna pada tabel periodik, yang menunjukkan apakah unsur tersebut termasuk dalam kelompok logam, metaloid, atau non-logam.
Anda dapat melihat perbedaannya dengan mencari unsur logam di sisi kanan tabel, sedangkan unsur non-logam berada di sisi kiri dan kelompok metaloid berada di antara logam dan non-logam.
Cara Menghafal Tabel Periodik
Ini dia cara mudah dan tips menghafalkan tabel periodik.
1. Cetak Lembaran Tabel Periodik
Anda disarankan untuk mencetak tabel periodik menjadi lembaran yang bisa dibawa kemana saja pergi. Kamu boleh menambahkan coretan-coretan yang membuat Anda menjadi lebih mudah ingat. Salinan-salinan tambahan bisa dijadikan sebagai bahan review atas materi yang telah kamu pelajari pada salinan pertama.
Metode ini sebaiknya diaplikasikan secara berulang untuk memudahkan dan mempercepat penghafalan. Jika kamu adalah tipe pembelajar visual dan kinestetis, menciptakan versi tabel periodikmu sendiri bisa menjadi opsi yang bagus. Metode ini akan membantu kamu memahami struktur tabel dengan lebih baik dan menjadi lebih familiar dengan unsur-unsur yang ada di dalamnya.
2. Kelompokkan Unsur-Unsur Secara Spesifik
Tabel periodik unsur kimia umumnya sudah disusun berdasarkan kategori tertentu yang biasanya ditandai dengan warna yang berbeda. Jika kamu merasa metode ini efektif, kamu dapat mencoba untuk mengatur ulang tabel periodikmu sendiri berdasarkan baris, kolom, massa atom, atau kategori lain yang menurutmu akan memudahkan proses penghafalan. Pendekatan ini memungkinkan kamu untuk menyesuaikan metode penghafalan sesuai dengan kemampuan dan preferensimu, memilih dari kategori mana kamu akan mulai menghafalkan.
3. Kaitkan Unsur Dengan Hal-Hal Yang Bersifat Umum
Kamu bisa mencoba menghafal tabel periodik kimia dengan membuat rangkaian kata atau frasa kreatif yang menghibur, misalnya “Becak Mang Kasim Sering Bawa Rambutan” ” untuk membantu mengingat rumus kimia untuk unsur Be, Mg, Ca, Sr, Ba, dan Ra
Metode ini bisa kamu modifikasi sesuai preferensimu atau dengan cara yang lebih berkesan dan mudah diingat. Sebagai contoh lainnya, kamu bisa memakai kata ‘Argentina’ untuk mengingat simbol unsur perak, yaitu ‘Ag’.
4. Hafalkan Dengan Lirik Lagu
Metode ini bisa menjadi sangat menarik karena kamu bisa memakai lagu favoritmu untuk memudahkan penghafalan. Bahkan, banyak lirik lagu yang dirancang khusus untuk membantu penghafalan tabel periodik yang bisa kamu temukan di internet. Ada juga versi karaoke dari lagu-lagu ini jika kamu lebih menyukai metode belajar seperti ini.
5. Kenali Asal Bahasa Lambang Unsur
Sebagian besar lambang dalam tabel periodik berasal dari istilah dalam bahasa Inggris, kecuali untuk 10 lambang yang diambil dari nama Latin dan 1 unsur (wolfram) dari bahasa Jerman.
Oleh karena itu, mengetahui asal-usul Latin dari unsur tertentu bisa membantu kamu dalam memahami beberapa nama unsur kimia anorganik. Perlu diketahui bahwa banyak bahasa Romantis (Perancis, Italia, Spanyol, dll) berasal dari bahasa Latin.
FAQ
Ada Berapa Unsur Dalam Tabel Periodik ?
Jumlah unsur kimia dalam tabel periodik terdiri dari 118 unsur. Mulai dari unsur pertama, Hidrogen, sampai unsur ke-118, Oganesson.
Namun, harap dicatat bahwa jumlah ini dapat berubah jika unsur baru ditemukan atau disintesis dan diakui oleh organisasi internasional seperti IUPAC (International Union of Pure and Applied Chemistry).
Apa Unsur Pertama Dalam Tabel Periodik ?
Unsur pertama dalam tabel periodik adalah Hidrogen (H). Hidrogen merupakan unsur yang paling ringan dan jumlahnya paling melimpah di alam semesta. Untuk di bumi, hidrogen sebagian besar terdapat dalam bentuk molekul, seperti dalam air (H2O) dan senyawa organik. (Pendidikan – redaksi)
 Decorvills.net | Insurance and Investment Blog
Decorvills.net | Insurance and Investment Blog


